Química:
https://www.youtube.com/watch?v=cmHn5Kn1Y-I; en este vídeo nos enseñan que la materia a todo aquello que ocupa un lugar determinado en el universo, posee una cantidad determinada de energía y está sujeto a interacciones y cambios en el tiempo, que pueden ser medidas. Desde un punto de vista químico, la materia es el conjunto de los elementos constituyentes de la realidad perceptible, o sea, lo que constituye las cosas a nuestro alrededor y a nosotros mismos.
También emplean el término materia como un sinónimo de sustancia, es decir, de la cosa de la que están hechos los objetos, y la comprendemos científicamente como un tipo de fenómeno distinto al de las fuerzas o energías: las dinámicas que interactúan con los objetos.
Nos dicen que la materia se encuentra en todas partes, y en cualquier estado físico. Hay materia en el aire que se respira así como en un vaso de agua. Todo lo que vemos, sentimos y tocamos, es materia, que es un elemento fundamental para el desarrollo de la vida en el planeta, es muy util este video para introducirnos a la quimica.

En el segundo vídeo es sobre los números cuánticos https://www.youtube.com/watch?v=zwisiN5XWh8, en este video nos explica sobre que es los numeros cuanticos, cuantos hay, que significa cada uno y como se emplean, a mi gusto esta muy bien explicado ya que te da algunos ejemplos y le entiendes con facilidad.
Configuración Electrónica
La configuración electrónica (o C.E) indica la posición de cada electrón dentro de la envoltura nuclear, indicando en el nivel energético en el que éste se encuentra y en que orbital. Cada electrón puede ser identificado específicamente gracias a sus cuatro números cuánticos, los cuales son:
Número Cuántico principal (n): Corresponde al nivel energético en donde se encuentra el electrón. Va desde 1 hacia arriba (1, 2, 3...)
Número Cuántico secundario o azimutal (l): Corresponde al orbital en donde se encuentra el electrón. Se representa por s (0), p (1), d (2) y f (3).
Número Cuántico Magnético (m): Indica la orientación del orbital donde se encuentra el electrón. Va desde -l hasta l (incluyendo el 0).
Número Cuántico de Spin o Giro (s): Este número cuántico se define tradicionalmente como el giro que posee el electrón. Dos electrones con el mismo giro no pueden tener un mismo m (solo se permiten dos electrones por m y deben tener spines (giros) opuestos). Se identifican tradicionalmente como -1/2 y +1/2 o -1 y +1, en esta página web se utilizará la primera identificación (-1/2 y +1/2).
Ahora para poder seguir avanzando en la configuración electrónica debemos conocer primero unos ciertos principios que nos ayudarán a comprender mejor como se desarrolla este tema. Dichos principios son:
Principio de Aufbau o de la menor energía: Este principio nos indica que todos los electrones partirán "llenando" los orbitales de menor energía posible. Si el de menor energía está lleno, seguirán con el que le sigue en energía y así sucesivamente.
Principio de Hund o de la máxima multiplicidad: Este principio nos dice que en caso de que existan orbitales atómicos con la misma energía, los electrones se distribuirán equitativamente en cada uno y cuando todos tengan un electrón se empezaran a llenar con los que les falten. Por ejemplo, si se tiene tres orbitales con la misma energía (denominados orbitales degenerados), los electrones entrarán de tal manera que los primeros tres electrones entrarán uno en cada orbital, todos con el mismo spin. Cuando esto ocurre se dice que el orbital (los orbitales en este caso) se encuentra semi-lleno. Posteriormente, se completaran los orbitales con los electrones que hagan falta para este efecto. Esto se comprenderá de mejor manera más adelante, cuando se hagan algunos ejemplos.
Principio de exclusión de Pauli: Este principio nos dice que cada electrón posee una combinación única de 4 números cuánticos que lo personaliza. No es posible que existan dos electrones con los 4 números cuánticos iguales. Esto quiere decir, que solamente pueden existir dos electrones por orbital, ya que existen dos espines (+1/2 y -1/2).

Si se fijan arriba hablé de los orbitales degenerados o con energías iguales, pero, ¿de dónde salen?, ¿cómo se sabe cuántos orbitales degenerados existen y quién los determina? Bueno la respuesta a estas preguntas las da el número cuántico magnético, ya que él es el encargado de indicarnos la orientación espacial de los orbitales. Ahora les colocaré un ejemplo para que quede mucho más claro todo esto que hasta aquí suena algo enredado.
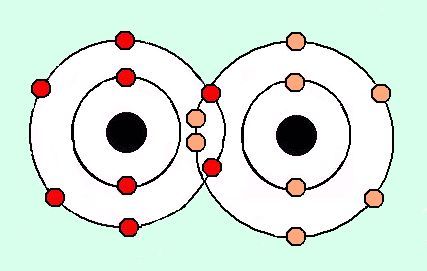
Por ejemplo, vamos a analizar los 6 electrones del átomo de carbono (C) (Imagen CE-1):
Imagen CE-1: Análisis de los 6 electrones del carbono en relación a sus números cuánticos.
Números Cuánticos de los electrones del Carbono
Como se puede ver en la imagen de arriba, cada electrón esta individualmente identificado por ciertos números cuánticos, y no existen dos electrones que se repitan los mismos cuatros números (principio de exclusión), también se puede ver que los electrones 5 y 6 se encuentran en orbitales degenerados, debido a que la orientación de los orbitales es distinta (máxima multiplicidad). Según la tabla el primer electrón entró en el de menor energía, el segundo, lo llenó (Principio de Pauling) y el tercero se situó en el que le seguí en energía (Principio de Aufbau). Los niveles de energía de los orbitales, y los orbitales existentes en cada nivel energético se muestran en la Imagen CE-3.
Si uno se da cuenta, la tabla de arriba es algo engorrosa cuando un átomo tenga más electrones, por lo que se necesita un método más simplificado para escribir exactamente lo mismo, es ahí donde se crea la configuración electrónica, la que para el ejemplo que hemos puesto, sería como sigue:
1s2 2s2 2px1 py1 pz0
Nótese que, a pesar de que en el último orbital degenerado no existen electrones, de igual manera se anota. Es importante recalcar que tanto las letras x, y, z (estas letras indican la orientación espacial de los orbitales) que figuran abajo de los orbitales p, como así también el orden de llenado (primero x, luego y, para finalizar en z) es por convención, debido a que, como los tres orbitales poseen la misma energía da lo mismo si un electrón entra en x, y o z.
Tabla Periódica Actual
Principio de exclusión de Pauli
Esta regla nos dice que en un estado cuántico solo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2\hbar y con proyecciones {\displaystyle \pm 1/2}.
También que en una orientación deben caber dos electrones excepto cuando el número de electrones se ha acabado, por lo cual el orden que debe seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin. El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria. El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres. "Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos". Es sencillo derivar el principio de Pauli, basándonos en el artículo de partículas idénticas. Los fermiones de la misma especie forman sistemas con estados totalmente antisimétricos, lo que para el caso de dos partículas significa que:
mismo estado cuántico |ψ>, el estado del sistema completo es |ψψ>.
Resultado de imagen para Principio de exclusión de Pauli

Regla del octeto
Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de espín +½ y otro de espín -½) Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece que el nivel electrónico se completa con 8 electrones, excepto el hidrógeno, que se completa con 2 electrones. Entonces el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógeno (en el caso del agua, por ejemplo), que cada uno necesita 1 electrón (el cual recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno. De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima, cercana al 91%. Ejemplo de ello: 10Ne: 1s2, 2s2, 2p6 regla del octeto: 11Na:(Ne)10, 1s2, 2s2, 2p6, 3s1
Resultado de imagen para Regla del octeto
Anomalías de configuración electrónica
Al desarrollar la configuración electrónica, encontramos una serie de excepciones. Por ejemplo, es más estable llenar dos medios orbitales que completar uno y dejar el otro a uno o dos electrones de estar completado a la mitad. Así, los metales del grupo 6 en vez de tener los orbitales externos completos y el orbital de un electrón de estar semi-completo, donarán un electrón del orbital , quedando ambos completos a la mitad: s1d5 en vez de s2d4. Igualmente, es más estable rellenar los orbitales d completamente, por lo que los elementos del grupo 11 tenderán a adoptar la configuración s1d10 en vez de s2d9.
Ejemplos de estas anomalías son:
Grupo VIB:
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 : es incorrecto.
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d5 : es correcto.
Grupo IB:
29Cu: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10 : es correcto.
ER: n + l
Donde:
n: nivel l: subnivel
Ejemplo:
4s: 4 + 0 : 4
3p: 3 + 1 : 4
4d: 4 + 2 : 6
5f: 5 + 3 : 8
6g: 6 + 4 : 10
7h: 7 + 5 : 12
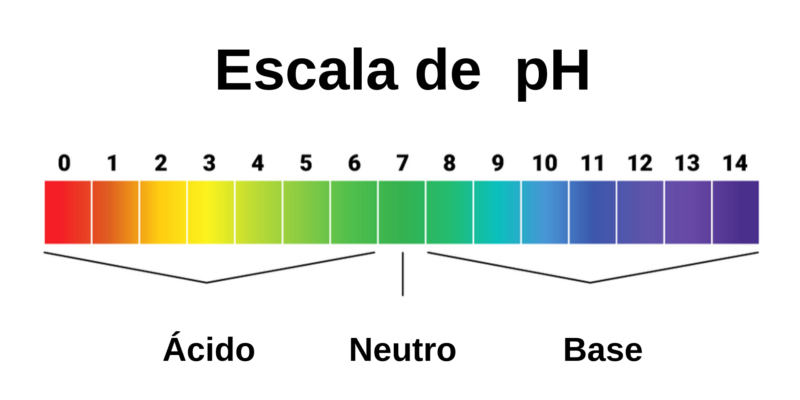
Para el siguiente tema nos cambiaron maestro entonces brincamos a otros temas que no vimos por ejemplo Acidos y Bases y era un tema muy importanto tuve que acurrir a este video: https://www.youtube.com/watch?v=E_xcacKMzyQ el cual la chava nos explica la definicion, tipos y como se clasifica.
Progresamos con las clases y nos topamos con el tema esquimetria que es un tema muy complejo y tuvimos que separar el tema en varios para despues solo unirlos y realizar ejercicios, el primer tema que vimos fue conversion de moles y fue algo rapido ya que nos enseño un video de como hacerlo y que dicho video es este: https://www.youtube.com/watch?v=Z8oHc8QOc5c
Después de esto vimos ya vimos como tal como hacer ejercicios de esquimetria y la verdad tuve dudas porque vi esta imagen y me confundió mas.

Entonces me despertó la necesidad de entenderle al tema para ello vi tal vídeo: https://www.youtube.com/watch?v=pV0BseLBejE y resolvió todas mis dudas ya que esta bien explicado iniciando con cosas muy sencillas y que iremos ocupando poco a poco desenrollándose el vídeo nos pone un ejercicio fácil de entender y que la verdad si entendí al 100.

el maestro a los pocos días nos mandó una evaluación a nuestros correos y que venían ejercicios ya vistos en clase entonces me puse leer y leer, encontré una buena pagina para que resuelvas tus dudas la cual es: https://es.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/stoichiometry-ideal/a/stoichiometry

Después vi que varios vídeos de química que había visto era de un solo canal y que es muy bueno para estos temas, anexo el canal: https://www.youtube.com/channel/UCTiu0apxEtCGpuLYeI-owkg
Actualmente seguimos viendo varios temas porque aún no vemos más temas.


Comentarios
Publicar un comentario